Calor latente: fusão, vaporização, solidificação, condensação - Ciência - 2023
science

Contente
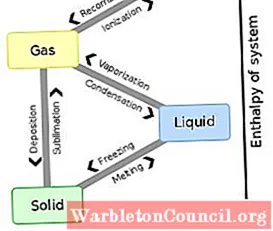
- Calor de fusão latente
- Calor latente de vaporização
- Calor latente de solidificação
- Calor latente de condensação
- Referências
o calor latente É aquele que não é "sentido", pois representa a energia térmica que é liberada ou absorvida durante uma mudança de fase, sem aumentar ou diminuir a temperatura do sistema termodinâmico. Existem vários tipos de calor latente, que são governados pelas mudanças de fase de uma substância.
Os tipos de calor latente são o calor latente de fusão, vaporização, solidificação e condensação. Em outras palavras, esses valores são as unidades de calor por massa necessárias para atingir a mudança de fase. No campo da termodinâmica, o estudo da transferência de calor e efeitos térmicos é comum.
Esses efeitos estão envolvidos em qualquer processo, mesmo aqueles que ocorrem a temperatura constante. Os dois tipos de calor que podem ser transferidos para um corpo ou substância e para o ambiente que o rodeia durante um processo são então observados, os quais são regidos pelas propriedades individuais da substância envolvida: calor sensível e o calor latente.
O calor sensível é aquele que se refere ao calor que é "sentir "ou medido no processo por meio de mudanças na temperatura do corpo. Em vez disso, o calor latente se refere ao momento em que a energia é absorvida ou liberada sem gerar mudanças na temperatura.
Calor de fusão latente
A fusão é um processo físico representado como a transição de fase de uma substância sólida para líquida. Portanto, o calor latente de fusão de uma substância, ou entalpia de fusão, é a alteração da entalpia que resulta da absorção de energia e que leva a substância em questão a passar da fase sólida para a fase líquida a pressão constante.
A temperatura na qual ocorre essa transição é chamada de temperatura de fusão, e a pressão é considerada como sendo 1 atm ou 101 325 kPa, dependendo do sistema trabalhado.
Graças à diferença nas forças intermoleculares, as moléculas em uma fase líquida têm maior energia interna do que uma fase sólida, então os sólidos requerem energia positiva (absorver calor) para derretê-los e atingir o líquido, enquanto os líquidos devem libere calor para congelar (solidificar).
Esta mudança de entalpia pode ser aplicada a qualquer quantidade de substância que atinge a fusão, não importa quão pequena, e é um valor constante (a mesma quantidade de energia) que é expresso em unidades de kJ / kg quando se deseja referir-se a unidades de massa.
É sempre uma quantidade positiva, exceto no caso do hélio, o que significa que o hélio congela ao absorver o calor. O valor do calor latente de fusão para a água é de 333,55 kJ / kg.
Calor latente de vaporização
Também chamada de entalpia de vaporização, é a quantidade de energia que deve ser adicionada a uma substância na fase líquida para que ela faça a transição para a fase gasosa. Este valor é função da pressão em que ocorre a transformação.
Geralmente está associado ao ponto de ebulição normal de uma substância, ou seja, o ponto de ebulição que tem quando a pressão de vapor do líquido é igual à pressão atmosférica ao nível do mar (1 atm).
O calor de vaporização depende da temperatura, embora possa ser assumido que permanece constante em pequenas faixas de temperatura e em temperaturas muito menores do que um.
Além disso, é importante ressaltar que o calor de vaporização diminui em altas temperaturas, até atingir a chamada temperatura crítica da substância, onde coincidem. Além da temperatura crítica, as fases de vapor e líquida tornam-se indistinguíveis, e a substância fica em um estado de fluido supercrítico.
Matematicamente, é expresso como o aumento da energia na fase de vapor em relação à energia na fase líquida, mais o trabalho que deve ser aplicado contra a pressão atmosférica.
O primeiro termo (aumento de energia) será a energia que será necessária para superar as interações intermoleculares que existem no líquido, onde aquelas substâncias com maiores forças entre ligações (água, por exemplo) terão maiores calores latentes de vaporização (2257 kJ / Kg ) do que aqueles com pouca força entre seus links (21 kJ / Kg).
Calor latente de solidificação
O calor latente de solidificação é o calor envolvido na mudança de fase de uma substância de líquida para sólida. Como mencionado acima, as moléculas de uma substância na fase líquida possuem maior energia interna do que as sólidas, portanto na solidificação a energia é liberada ao invés de absorvê-la, como na fusão.
Assim, em um sistema termodinâmico pode-se dizer que o calor latente de solidificação é o oposto do de fusão, uma vez que a energia envolvida é liberada para o exterior quando ocorre a mudança de fase.
Ou seja, se o valor do calor latente de fusão da água for 333,55 kJ / Kg, então o calor latente de solidificação ou valor de congelamento da água será -333,55 kJ / Kg.
Calor latente de condensação
O calor latente de condensação é aquele que ocorre quando há mudança de fase de uma substância gasosa para líquida, como no caso do vapor d'água.
Em relação à energia de cada molécula, nos gases ela é ainda maior do que nos líquidos, então também há liberação de energia ao passar da primeira fase para a segunda.
Novamente, pode-se dizer que o valor do calor latente de condensação será o mesmo da vaporização, mas com valor negativo. Então, um calor latente de valor de condensação para a água será igual a -2257 kJ / Kg.
Em temperaturas mais altas, o calor de condensação diminuirá, enquanto o ponto de ebulição aumentará.
Referências
- Calor latente. (s.f.). Obtido em en.wikipedia.org
- Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2007). Introdução à Termodinâmica da Engenharia Química. México: McGraw-Hill.
- Levine, I. (2002). Química Física. Madrid: McGraw-Hill.
- Potência, N. (s.f.). Poder nuclear. Obtido em nuclear-power.net
- Elert, G. (s.f.). The Physics Hypertextbook. Obtido em physics.info


